
期刊:Immunotherapy, IF 3.028
近年来,抗PD-1/ PD-L1免疫疗法在治疗多种实体瘤方面取得了突破性进展,可显著改善癌症患者的OS和PFS。食管癌是临床上具有挑战性的恶性肿瘤,预后较差。2020年CSCO食管癌诊疗指南推荐帕博利珠单抗用于PD-L1阳性食管癌的二线或后续治疗,但对于食管癌一线免疫治疗的报道很少,相关的临床试验都还在进行中。
为此,山东大学齐鲁医院(青岛)化疗科曹芳丽教授团队在临床治疗中基于基因检测结果,对一例IV期食管癌患者进行帕博利珠单抗联合化疗的一线治疗,并对患者治疗过程中的临床反应进行解析。裕策生物参与其中的基因检测工作。
案例展现
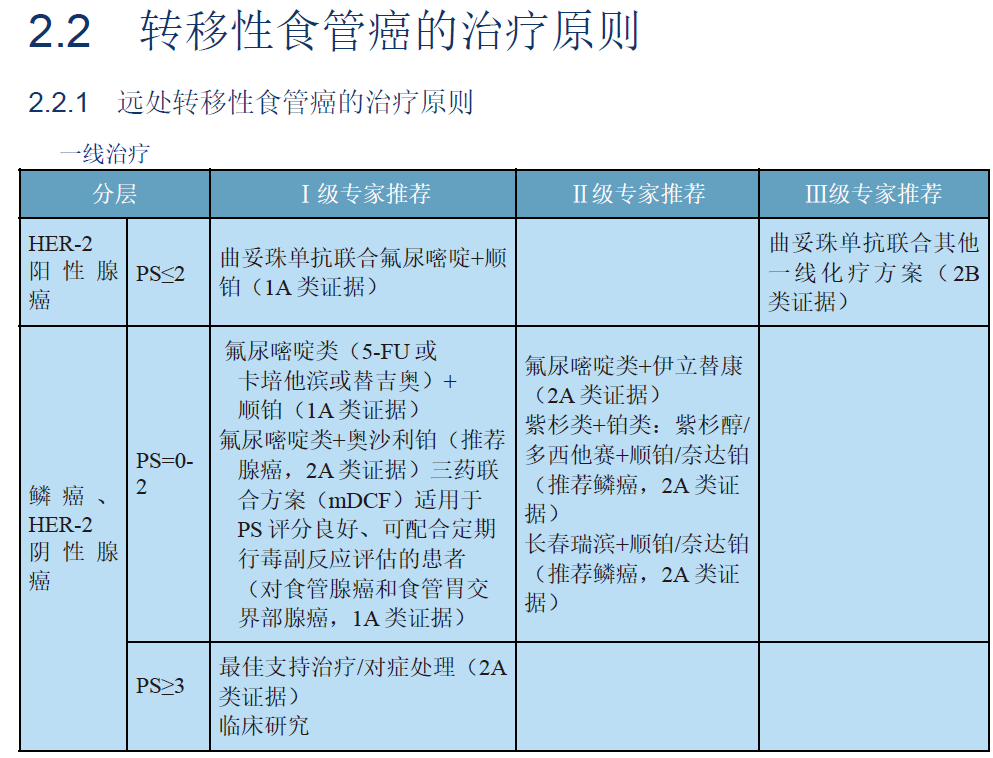
2018年12月,一名59岁男性患者,因复发性全身转移性食管癌入院就诊(2007年接受根治性食管切除术)。体检显示左肩明显压痛。CT结果显示右侧锁骨上软组织、右侧颌下腺和纵隔周围有多处淋巴结肿大,左前下壁胸膜结节,左肱骨头和右第五肋骨溶骨性破坏。淋巴病理结果确认为IV期食管鳞癌;基因检测结果为TP53(R282W)突变,KRAS、EGFR和CCND1的拷贝数增加(CNV)。免疫治疗相关指标为:微卫星稳定(MSS),中度TMB(4.03Mut/Mb),免疫组化(IHC)分析显示,组织标本PD-L1的TPS(肿瘤比例评分)为6%~10%,CPS(联合阳性评分)为4.2(图1)。
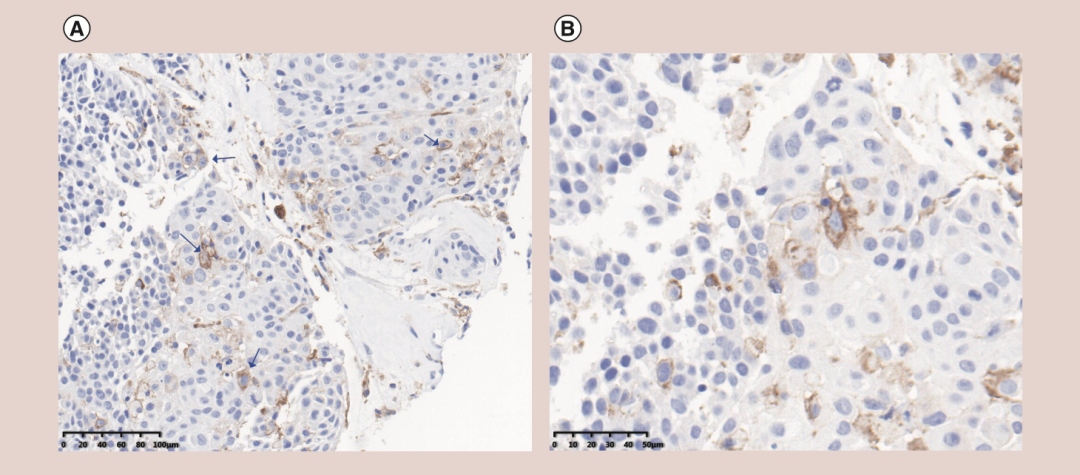
图1 患者肿瘤组织PD-L1免疫组化结果
考虑患者诉求,经过相关机构伦理委员会批准和患者知情同意,该患者在临床上采用了免疫检查点抑制剂帕博利珠单抗联合化疗进行治疗。用帕博利珠单抗(200mg,q3w)、白蛋白紫杉醇和奈达铂(白蛋白紫杉醇260mg/m2,d1;奈达铂100mg/m2,d1)治疗3个周期后,患者CT显示转移灶明显缩小,临床疗效评价为PR(图2)。

图2 主要病变病灶的CT结果
CT显示右锁骨上软组织周围有多处淋巴结肿大(图2.A),左前下壁有胸膜肿块(图2.B),左肱骨头有溶骨性破坏(图2.C)。图中箭头表示病变部位。3个周期后锁骨上淋巴结及左前下胸膜肿块明显减少(图2.D、图2.E)。左髂骨溶骨性破坏成骨(图2.F)。
在治疗过程中,治疗1个周期后患者临床出现IV度骨髓抑制,G-CSF(粒细胞集落刺激因子,主要用于预防化疗导致的中性粒细胞减少症)治疗后病情好转。因此,在第二个治疗周期后,临床对该患者采用较长的G-CSF治疗。另外,在第四个治疗周期后出现了三级血小板减少症,用重组人血小板生成素治疗后改善。后续对化疗方案进行调整,采用帕博利珠单抗联合白蛋白紫杉醇进行2个周期治疗。在6个周期的免疫联合化疗治疗后,患者CT结果显示病灶稳定。
在这之后,患者接受帕博利珠单抗单药作为维持治疗。至此,从2019年1月到2019年7月,患者共接受6个周期的免疫联合化疗和2个周期的免疫单药维持治疗,临床治疗效果较好,未观察到与免疫相关的不良反应。最终,该患者随访至2019年11月,死于胃肠道出血。
小结展望
目前,肿瘤学指南推荐单一疗法作为鳞癌患者的一线治疗,但这种疗法对患者的生存益处有限,帕博利珠单抗获批用于PD-L1阳性食管癌的二线或后续治疗。目前,许多研究表明免疫治疗和化疗具有协同作用,一些临床试验已经证实了这一点。
KEYNOTE-181研究是全球首个证实PD-1抑制剂疗效的大型III期临床研究,研究之初即预设了中国亚组的统计学分析要求,而非是一个回顾性分析结果,研究证实与化疗相比,中国人群能够从帕博利珠单抗中显著获益,pembrolizumab的OS更好(9.3 vs 6.7 mOS;危险比:0.69;95%CI:0.52-0.93),ESC阳性总评分≤10的mOS为10.3个月,而同期为6.7个月。
而后续公布的ATTRACTION-03研究和ESCORT研究也分别证实免疫治疗能提高食管癌患者的生存获益。同时,食管癌免疫治疗也并非仅仅局限于单药治疗,食管癌免疫治疗联合化疗或抗血管生成治疗,能够进一步提高患者的客观缓解率,大约80%左右,所以针对体能状况佳、肿瘤负荷大的食管癌患者,联合治疗是可尝试的方案之一。相对于单药治疗,联合治疗起效更快,患者客观缓解率更高,而且免疫治疗一旦起效,“拖尾效应”明显,但需要注意联合治疗毒副反应的发生。
作为免疫化疗治疗晚期食管癌的一线治疗的KEYNOTE-590研究仍在进行中。该文章报告的病例治疗效果很好,没有发生免疫不良反应。我们相信,KEYNOTE-590临床试验将是成功的,并在未来改善食管癌患者的一线治疗。
基于检查点抑制剂的免疫疗法将实体肿瘤治疗带入了一个新时代。但是,这种方法也带来了新的临床挑战,例如预测疗效,不良反应,与免疫疗法相关的超进展。抗肿瘤免疫应答是一个复杂的过程,涉及几种类型的免疫细胞和分子。寻找免疫疗法预测性biomarker更具挑战性。PD-L1在肿瘤细胞中的过表达可能会通过抑制细胞毒性T细胞的功能而导致免疫逃逸。因此,PD-L1的表达被认为是预测ICI疗效的biomarker。但是研究人员发现,非小细胞肺癌肿瘤中PD-L1表达低或无表达的患者,也可能会受益于抗PD-L1治疗。
2017年5月,FDA批准了Keytruda用于治疗携带MSI-H/dMMR,且不可切除或转移性实体瘤的患者。这也是首次依照biomarker进行区分的抗肿瘤疗法。2020年6月17日,FDA批准Keytruda单药用于治疗TMB-H(组织肿瘤突变负荷≥10个突变/百万碱基),既往治疗后疾病进展,且无满意替代治疗方案的晚期实体瘤患者。这是Keytruda获批的第二个基于biomarker的“不限癌种”癌症疗法。
还有很多免疫疗法相关的超进展和不良反应指标值得临床专家和研究人员进一步去挖掘,期望未来可以更加有效地预测免疫治疗。
专家介绍

曹芳丽
山东大学齐鲁医院(青岛)化疗科副主任
医学博士
兼任
山东省分子靶向免疫治疗委员会常务委员
山东省医师协会肿瘤化疗医师分会常委委员
山东省生物医学工程学会生物定向治疗青委会常委
山东省医学会姑息治疗委员会委员
山东省抗癌协会肿瘤临床协作分会委员
青岛市抗癌协会第六届理事会常务理事
青岛市医疗卫生优秀青年医学人才
青岛市医学会肿瘤分会委员
奥地利“Kaiser-Franz-Josef-Spital”肿瘤中心研修
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

