
期刊:Briefings in Bioinformatics,IF:8.999
“人类白细胞抗原”(HLA)基因可以编码“人类主要组织相容性复合体”(MHC)蛋白,它们是人体免疫系统的重要组成部分。精准的HLA基因分型,能帮助预测患者ICI治疗的疗效,且是肿瘤新生抗原预测、肿瘤疫苗制备的关键环节。
背景知识
当毒性T细胞与产生了抗原的细胞接触时,会识别到抗原并清除该细胞(见下图);HLA-II类基因编码MHC 2类蛋白,它们存在于抗原呈递细胞中并且能识别细胞内和细胞外的抗原,最终通过CD4+辅助T细胞刺激B细胞产生抗体。

HLA与肿瘤免疫治疗
肿瘤细胞是一种特别狡猾的变异细胞,虽然他们会产生与普通细胞完全不同的肿瘤特异性抗原(新生抗原),但是它们很会隐藏和保护自己,例如通过让HLA基因发生杂合性缺失(LOH)、下调HLA基因表达来减少被转运到细胞表面的抗原;分泌抗程序性死亡分子1的配体(PD-L1)来阻止被毒性T细胞消灭;阻碍免疫细胞浸润到肿瘤内等方式。
随着肿瘤免疫治疗取得了越来越多的突破,现已成为最广泛使用的泛癌种治疗方法之一,越来越多的患者受益于免疫治疗。最近的研究表明,HLA-I基因型(如HLA-B44和HLA-B62)和杂合性(LOH)状态的缺失与患者的预后和免疫治疗的疗效相关。在肿瘤疫苗的应用中,HLA的分型直接影响到新生抗原的预测,从而影响疫苗的制备。因此,HLA的准确分型对于免疫治疗意义重大。但是,HLA的多态性高的特点,使得精准分型成为挑战。
现有分型方法的局限
基于血清学和PCR的方法是当前HLA分型的主流方法,这些方法具有速度慢、分辨率低、无法识别稀有的HLA亚型或成本高等缺点。
随着NGS技术的发展,基于NGS技术的肿瘤基因组检测在临床和科研中得到广泛应用及NGS数据的HLA分型技术亦发展迅速,裕策生物的肿瘤检测产品可以基于NGS数据一站式检测患者的肿瘤基因组和HLA分型,减少了额外的HLA检测步骤、降低成本、减少肿瘤患者宝贵的等待时间,帮助肿瘤患者获得更佳的治疗方案和治疗疗效。
闲话少叙,接下来看看我们为提高HLA分型准确性做了什么吧。
(以下内容专业术语过多,看晕了的朋友可以直接滑到结尾点赞 (⊙ˍ⊙)。)
研究内容
如下图所示,基于WES和RNA-seq数据的HLA-I分型,准确性最高的工具都是OptiType。并且基于WES数据的HLA-I分型的准确性高于基于RNA-seq数据。
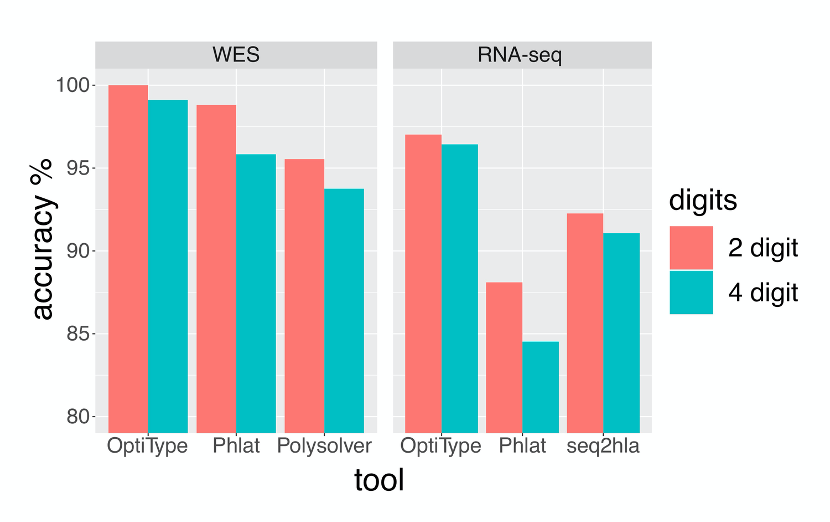
图1. 使用四个工具对WES,RNA-seq数据进行HLA分型的准确率
如下图所示,我们对比三个工具的HLA-I分型准确性,发现对照样本都高于肿瘤组织,其中分型准确性最高的工具仍是OptiType。
为了再次验证这个结果,我们用内部开发工具对选取的样本进行测序数据随机梯度抽取reads,模拟不同测序量的肿瘤和对照样本,然后用OptiType分别进行HLA-I分型,并统计模拟样本的HLA-I分型准确性。如图2.b所示,随着reads数量减少,模拟肿瘤样本和模拟对照样本的分型准确性逐渐下降,且对照样本的分型准确性一直高于肿瘤样本。
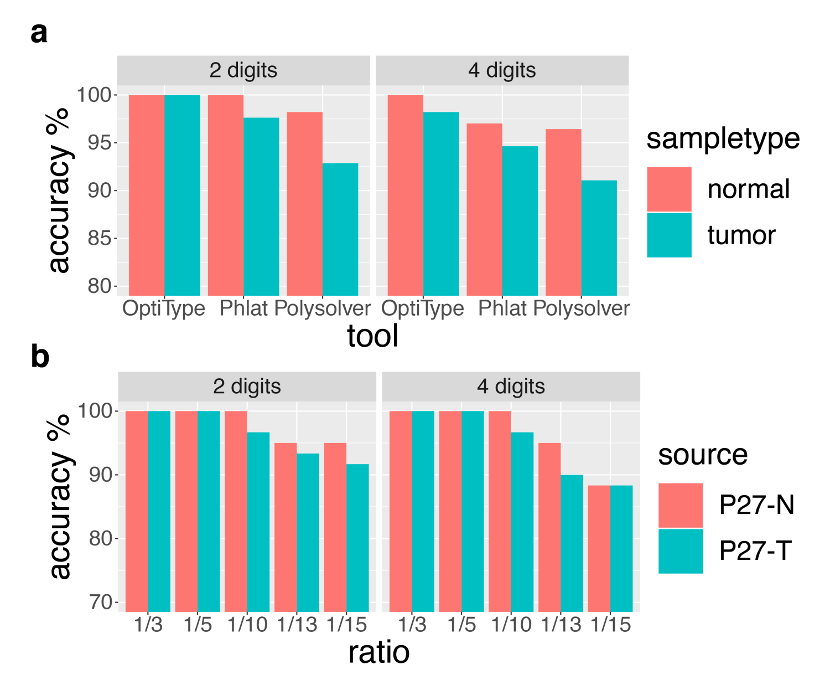
图2.a 使用三个工具对肿瘤和对照样本进行HLA-I分型的准确率
b.梯度模拟样本的HLA-I分型准确率

结论
想必大家看这么久都困了,来看看我们的主要结论吧:
参考文献:
Yi et al., Investigations of sequencing data and sample type on HLA class Ia typing with different computational tools, Briefings in Bioinformatics, 2020, 7
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

